盛京微创:晚期癌痛的精确狙击手~微创经皮消融技术
盛京微创 2019年3月美国国家综合癌症网络(NCCN)发布的成人癌痛指南指出,微创消融技术可缓解转移性骨癌痛,并预防骨折、对骨病变行手术或放射治疗及脊髓受压等骨骼相关事件(skeletal-related events,SREs)发生。转移性骨癌痛常见于多种类型癌症晚期,包括多发性骨髓瘤、乳腺癌、前列腺癌等,主要治疗方法是放疗。如果药物镇痛不充分或存在放疗禁忌,微创经皮消融可作为替代镇痛方案。
微创经皮消融技术包括射频消融(radio frequency ablation,RFA)、微波消融、冷冻消融和高强度聚焦超声等,通过使用不同消融模式对肿瘤或神经组织进行干扰,破坏肿瘤-骨膜界面的痛觉神经传递,抑制破骨细胞活性和肿瘤细胞释放的神经刺激因子,实现瘤体减压,从而减轻疼痛。盛京微创大医联盟专家认为,微创经皮消融技术是直接针对肿瘤和痛觉神经传导的精确狙击手,可以精准解决癌痛问题。
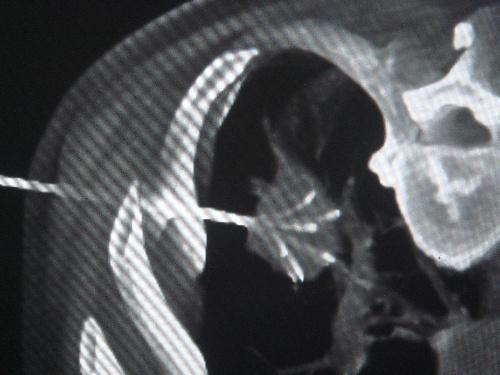
Deschamps等评估经皮消融治疗转移性骨癌痛的有效率以及疗效的影响因素,对89例接受经皮消融手术患者平均随访22.8月,意向治疗分析显示术后1年完全有效率为67%(95%CI:50%~76%);多变量分析结果显示,肿瘤寡转移状态(转移部位为1~5个)、转移与原发肿瘤非同时发生、转移病灶<2 cm、无皮质骨和附近神经组织侵犯,是经皮消融术后有效率的积极影响因素。RFA是通过影像引导将射频针置入肿瘤骨转移部位,高频交流电流通过针尖传导至周围组织,引起组织发热和细胞坏死。其优势是细胞的快速死亡以及消融范围、温度的可控性,但不能实时观察到消融区域。
RFA可以缩小脊柱转移瘤体积从而建立腔隙,以便联合椎体成形进行骨水泥注入。Reyes等的多中心、回顾性研究纳入49例(72个)脊柱转移瘤伴疼痛的患者,行RFA联合椎体成形术,评估治疗前和治疗后2~4周疼痛VAS评分、ODI的变化,结果显示,疼痛VAS评分从7.9±2.5降至3.5±2.6(P<0.0001),ODI从34.9±18.3降至21.6±13.8(P<0.0001),说明两者联用可以缓解脊柱转移瘤引发的疼痛并改善功能。微波消融相比于RFA的优势主要在于能获得持续更高的瘤内温度、更大的肿瘤消融体积和更快的消融时间。
RFA在操作过程中因温度过高引起组织汽化或炭化,从而形成电绝缘体发生阻抗效应,而微波本身的电磁特性使其并不受阻抗效应的影响,允许肿瘤内温度驱动得更高,在更短的消融时间内产生相当大的消融区;同时,该技术受“散热”效应影响小,操作时疼痛较少。近期,Deib等报道一项回顾性研究,纳入65例77个肿瘤骨转移灶行微波联合骨水泥成形治疗,比较术后24h、2~4周及20~24周与术前疼痛VAS评分,以及肿瘤局部控制情况,结果显示,平均VAS评分在术后各时间点分别为1.01、1.71和2.01,显著低于术前VAS评分(6.32),末次随访显示64.6%的患者未发生肿瘤局部进展,所有患者未出现手术相关并发症。这项研究表明微波消融对于缓解肿瘤骨转移的疼痛和肿瘤局部控制具备有效性和持续性。
冷冻消融是使用有加压氦气快速膨胀功能的特制冷冻探针,消融时冰球形成后通过将加压氦气快速灌注至冷冻探针中,可在几秒钟内使温度降至-100℃,从而实现组织快速冷冻消融。在成像期间可实现膨胀冰球清晰可视化,从而使消融区能够精确监测并达到多个冷冻探针同时使用的目的。但其较RFA的成本更高,操作用时更长。Ma等的回顾性研究纳入45例非小细胞肺癌共76处骨转移病变,分别行RFA(63%)、冷冻消融(35%)和微波消融(1.3%),比较术后4周与术前疼痛数值评定量表评分(Numeric Rating Scale,NRS)变化,放射学评估术后肿瘤局部控制情况,结果显示,NRS由术前7.5±2.3显著降至术后3.7±3.5(P<0.00001),术后3、6和12个月肿瘤局部控制率分别达83%、77%和68%,并发症(如血肿形成、放射性疼痛或其他神经损伤)的总体发生率为2.6%。
HIFU是一种完全无创的介入技术,由产生超声能量的发生装置和将高强度超声波聚焦成针对明确目标区域的换能器组成,在MRI或超声引导下,将高强度超声波聚焦在小的界限清楚的区域上,从而实现精确局部消融的目的。HIFU的换能器包含可以在幅度和相位上具有单独调节能力的元件组,将焦点电子转向到不同位置,从而可以在不移动患者的情况下靶向定位至更宽区域。
Hurwitz等的Ⅲ期临床试验招募147名受试者,随机接受MRI引导HIFU治疗(112例)或安慰剂(35例),主要终点HIFU有效率为64.3%,而安慰剂组仅为20%(P<0.001),超声疼痛为HIFU的常见不良事件,发生率为32.1%,病理性骨折(2例)、皮肤烧伤(1例)和神经病变(1例)也偶有发生,但60.3%的不良事件在治疗当天即缓解。HIFU作用机制可能是通过消融缩小肿瘤体积,从而减轻周围神经压力、局部热效应所致神经减少和去神经化,以及高强度聚焦超声所产生的空化压力和声压暂时改变细胞形态,以致膜蛋白功能障碍、膜牵拉引起离子通道激活和细胞膜电位改变;这些变化可以引起神经元兴奋和动作电位传递,通过中枢或外周神经系统中伤害性刺激的神经调节来缓解疼痛;此外,通过其热效应和机械效应诱导血管和细胞膜通透性增加,提高细胞代谢状态,并增强肿瘤细胞对化疗药物敏感性来增强药物毒性,还能刺激机体特异性免疫应答的抗癌作用,实现肿瘤局部控制。

